Diese Inhalte sind den Nutzenden von Meditricks vorbehalten.
Hier kannst Du einen Zugang erwerben.
Du bist neu hier? Informiere Dich über Meditricks.
Hast Du bereits einen Zugang?
Melde Dich bitte unter 'Profil' an.

Hier eine Vorschau,
wie wir dieses Thema behandeln und wie unsere Eselsbrücken aussehen:
Chemische Bindungen
Basiswissen
-
Allgemein
Chemische Bindungen
Alchemisten-Verbindung
Atome treten in der Umwelt selten als Einzelgänger auf: Sie interagieren mit den Atomen ihrer Umwelt und gehen unterschiedliche chemische Bindungen mit ihnen ein.
-
Atombindung
Kovalente Atombindung: bindende Elektronenpaare
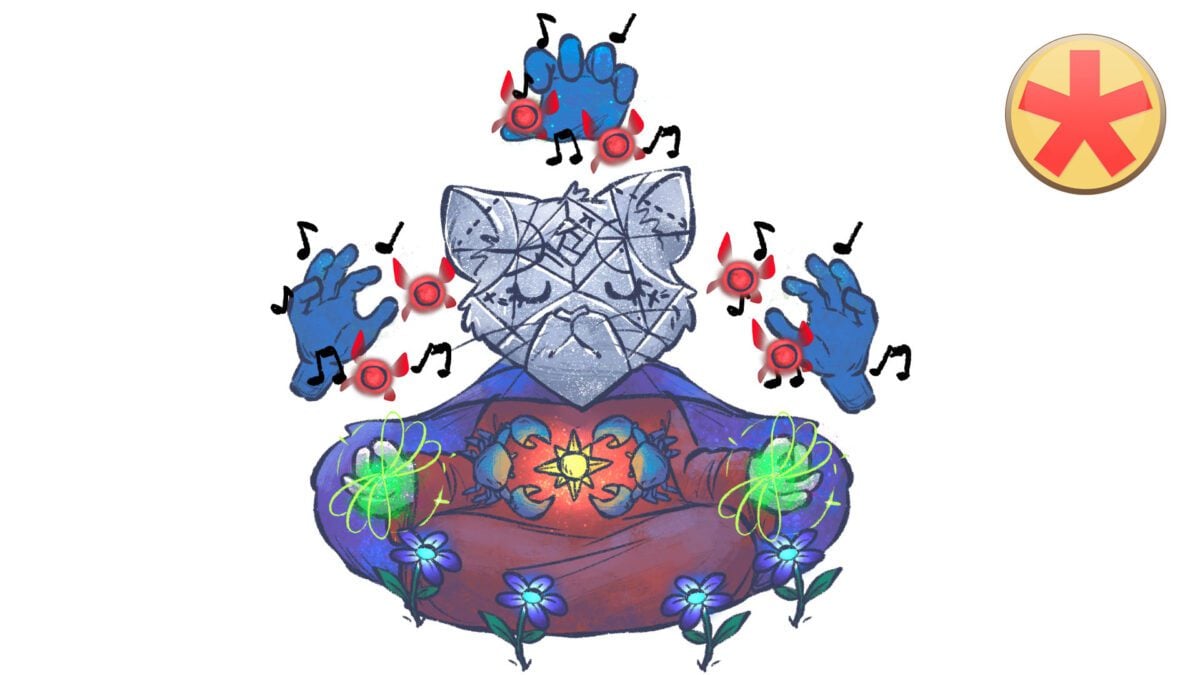
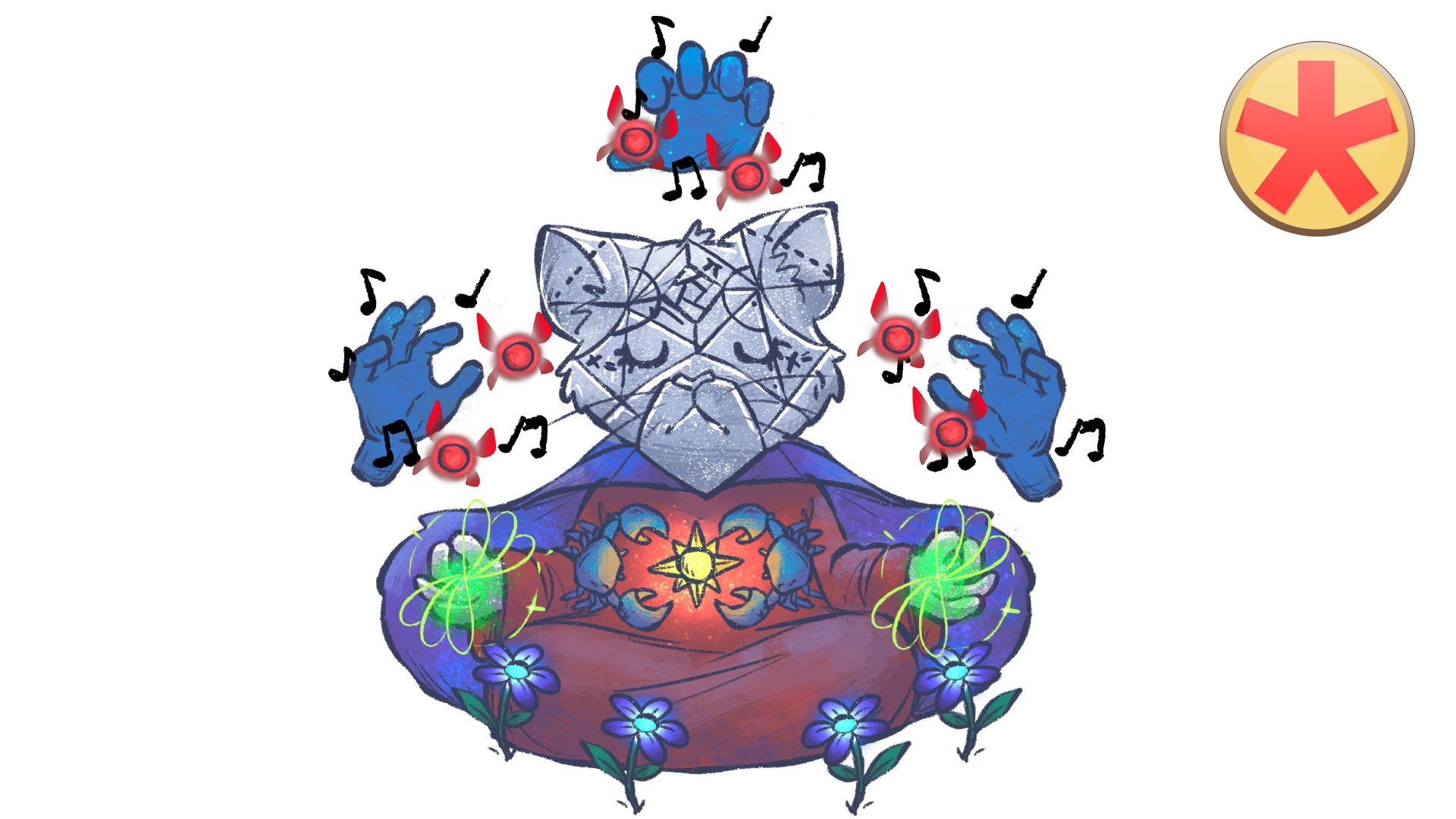
Cobra-Symbol: verbundene Hände entlassen Elektronen
Wenn sich zwei Atome ihre Valenzelektronen teilen und mind. ein Elektronenpaar bilden, spricht man von der kovalenten Bindung (“Ko-Valenzelektronen”). Die Paare werden mit Valenzelektronen gebildet und “bindendes Elektronenpaar” genannt. Beide Bindungspartner “spendieren“ ein Elektron.
-
Atombindung
Stabile Konstellation
Stab
Die Bindungspartner erreichen eine energetisch günstigere und damit stabilere Konstellation als alleine.
-
Atombindung
Ziel: Gemeinsam Oktettregel erfüllen (z.B. H2O)
Ziel: Beschwörung des Oktopus (Wasser)
Die kovalente Bindung ermöglicht Atomen, die Oktettregel zu erfüllen. Beispiel Wasser: Sauerstoff hat 6 Valenzelektronen, möchte aber 8. Wasserstoff hat 1 Außenelektron, möchte aber 2 (“Duettregel”). Zusammen haben 1 O- und 2 H-Atome 8 Valenzelektronen, wenn sie Wasser (H2O) bilden. Die Wasserstoffatome etablieren je eine Einfachbindung zu Sauerstoff (= zwei Elektronenpaare werden geteilt).
-
Atombindung
Freie Elektronenpaare: nicht an Bindung beteiligt
Freiheits Elektronenpaar
Die Elektronenpaare, die nicht an einer gemeinsamen Bindung zwischen zwei Bindungspartnern teilnehmen, werden als freie Elektronenpaare bezeichnet.
...
Expertenwissen
-
Atombindung > Sonderfall Komplexverbindung
Enzyme: Aktive Zentren
Enzian: aktives Zentrum
Die aktiven Zentren von Enzymen enthalten oft komplexe Verbindungen (Eisen-Schwefel-Cluster).
Beginne das Lernen mit unseren Eselsbrücken,
werde Teil der Lernrevolution.
Neu
Die 10 neuesten Meditricks:
Gereift unter der Sonne Freiburgs. mit viel Liebe zum Detail ersonnen, illustriert und vertont. Wir übernehmen keine Haftung für nicht mehr löschbare Erinnerungen.