Diese Inhalte sind den Nutzenden von Meditricks vorbehalten.
Hier kannst Du einen Zugang erwerben.
Du bist neu hier? Informiere Dich über Meditricks.
Hast Du bereits einen Zugang?
Melde Dich bitte unter 'Profil' an.

Hier eine Vorschau,
wie wir dieses Thema behandeln und wie unsere Eselsbrücken aussehen:

Atomhülle
Basiswissen
-
Atomhülle
Atomhülle
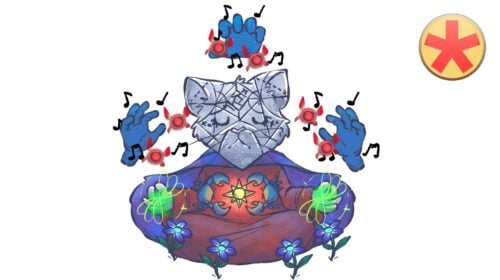
Aura der Alchemisten
Die Atomhülle ist im Vergleich zum Kern deutlich größer. Atomos Aura repräsentiert Orbitale und Elektronen.
-
Atomhülle
Elektron: negative Ladung
Rote Energie: Minuszeichen
Die Hülle wird von negativen Elektronen gebildet. Sie halten sich rund um den positiven Kern auf.
-
Atomhülle
Atomhülle: Elektronen (neg. geladen)
Aura: voller Elektronen
Die Atomhülle ist demnach negativ geladen.
-
Atomhülle
Elektron und Proton: gleicher Ladungsbetrag
Elektron und Proton bewerfen sich mit gleichem Blitz
Trotz der unterschiedlichen Masse ist der Ladungsbetrag von Elektronen und Protonen gleich. Bei neutralen Atomen ist die Elektronen- gleich der Protonenzahl: Negative und positive Ladungen gleichen sich also aus.
-
Atomhülle
Atomhülle: bestimmt chemisches Verhalten u. Atomgröße
2 Elektronen mit Aura: Komisches Gesicht + Größenvergleich
Da die Elektronen den direkten Kontakt zur “Außenwelt” haben, bestimmen sie die chem. Eigenschaften des Atoms. Außerdem ist die Atomgröße von der Hülle abhängig.
...
Expertenwissen
-
Bohrsches Atommodell
K-Schale: 2 Elektronen, L-Schale: 8 Elektronen
Kiwi: Zweig, Limette: Oktopus
Die maximale Anzahl der Elektronen pro Schale ergibt sich aus der Formel 2n2 (n = Schalenzahl). Die K-Schale kann 2 Elektronen halten, die L-Schale (Schale 2) 8.
-
Orbitalmodell
Hauptquantenzahl: Schalennummerierung
Haupt von Kant: Schale
Es gibt 4 Quantenzahlen, welche die Elektronen definieren. Die Hauptquantenzahl gibt die Schale an, in der sich das Elektron aufhält (1. Schale = Hauptquantenzahl 1).
-
Orbitalmodell
Nebenquantenzahl: Schalenform
Reben neben Kant: formen Schale
Die Nebenquantenzahl gibt mit Kleinbuchstaben die Form der Schale an. In der Nomenklatur einer Elektronenkonfiguration steht zuerst die Quantenzahl, dann die Nebenquantenzahl und dann die Elektronenanzahl: 1s2 → Auf der ersten s-förmigen Schale befinden sich 2 Elektronen.
...
Beginne das Lernen mit unseren Eselsbrücken,
werde Teil der Lernrevolution.
Neu
Die 10 neuesten Meditricks:
Gereift unter der Sonne Freiburgs. mit viel Liebe zum Detail ersonnen, illustriert und vertont. Wir übernehmen keine Haftung für nicht mehr löschbare Erinnerungen.